Pozostałe odpowiedzi są poprawne, ale myślę, że możesz skorzystać z bardziej „mikroskopijnego” spojrzenia na to, co się tutaj dzieje.
Za każdym razem, gdy jedna substancja (substancja rozpuszczona) rozpuszcza się w innej (rozpuszczalniku) , co się dzieje w skali molekularnej to fakt, że cząsteczki substancji rozpuszczonej są otoczone cząsteczkami rozpuszczalnika.
Co jest przyczyną tego? Jak opisał @Chris, obowiązują tu dwie zasady - termodynamika i kinetyka .
Mówiąc prościej, możesz pomyśleć o termodynamice jako odpowiedzi na pytanie „jak bardzo się rozpuści, jeśli będę czekać nieskończoną ilość czasu”, podczas gdy kinetyka odpowiada na pytanie „jak długo muszę czekać, zanim ilość X się rozpuści”. Na oba pytania zwykle nie jest łatwo odpowiedzieć w skali makroskopowej (nasz świat), ale obydwoma rządzą dwie bardzo łatwe do zrozumienia zasady w skali mikroskopowej (świata cząsteczek): potencjał i energia kinetyczna .
Energia potencjalna
W skali makroskopowej zazwyczaj myślimy tylko o grawitacyjnej energii potencjalnej - polu odpowiedzialnym za siłę grawitacji. Jesteśmy przyzwyczajeni do myślenia o obiektach znajdujących się wysoko nad powierzchnią ziemi, spadających w kierunku ziemi, gdy nadarzy się taka możliwość. Jeśli pokażę ci zdjęcie skały siedzącej na powierzchni ziemi:
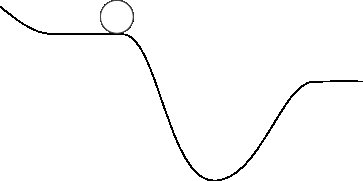
A potem zapytam: „Gdzie ta skała pójdzie?” masz całkiem niezły pomysł: przejdzie do najniższego punktu (uwzględniamy tutaj tarcie).
W skali mikroskopowej pola grawitacyjne są wyjątkowo słabe, ale na ich miejscu mamy pola elektrostatycznej energii potencjalnej . Są one podobne w tym sensie, że rzeczy próbują przejść od energii o wysokim potencjale do energii o niższym potencjale, ale z jedną kluczową różnicą: możesz mieć ładunki ujemne i dodatnie, a kiedy ładunki mają przeciwny znak, przyciągają się nawzajem, a kiedy mają ten sam znak, odpychają się.
Teraz szczegóły tego, w jaki sposób każda pojedyncza cząsteczka uzyskuje określony ładunek, są dość skomplikowane, ale możemy uciec od zrozumienia tylko jednej rzeczy:
Wszystkie cząsteczki mają między sobą atrakcyjną energię potencjalną, ale wielkość tej potencjalnej energii jest bardzo zróżnicowana. Na przykład siła między atomem wodoru na jednej cząsteczce wody ( $ H_2O $ ) a atomem tlenu na innej cząsteczce wody jest około 100 razy większa niż siła między dwoma cząsteczki tlenu ( $ O_2 $ ). Dzieje się tak, ponieważ różnica ładunków w cząsteczkach wody jest znacznie większa (około 100 razy) niż różnica ładunków w cząsteczkach tlenu.
Oznacza to, że zawsze możemy myśleć o energii potencjalnej między dwoma atomami jako o czymś w ten sposób:
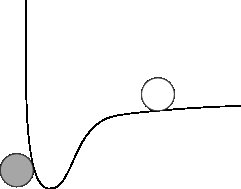
Cząstka „duch” reprezentuje atom stacjonarny, a linia reprezentuje „powierzchnię” energii potencjalnej, którą mógłby zobaczyć inny atom. Na tym wykresie miejmy nadzieję widać, że poruszający się atom miałby tendencję do opadania w kierunku atomu stacjonarnego, aż do momentu jego dotknięcia, w którym to momencie zatrzymałby się. Ponieważ wszystkie atomy mają pewną siłę przyciągania między sobą, a zmienia się tylko wielkość, możemy zachować ten obraz w pamięci i po prostu zmienić głębokość potencjalnej energii „dobrze”, aby siły były silniejsze lub słabsze .
Energia kinetyczna
Zmodyfikujmy nieco pierwszą powierzchnię energii potencjalnej:
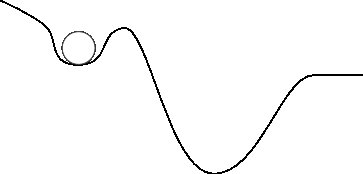
Teraz, jeśli zapytam „dokąd pójdzie kamień?”, odpowiedź będzie trochę trudniejsza. Powodem jest to, że można stwierdzić, że skała jest „uwięziona” w pierwszej małej dolinie. Intuicyjnie prawdopodobnie zauważysz, że gdyby miał jakąś prędkość lub jakąś energię kinetyczną , mógłby uciec z pierwszej doliny i skończyć w drugiej. Myśląc o tym w ten sposób, możesz również zauważyć, że nawet na pierwszym zdjęciu potrzebowałaby odrobiny energii kinetycznej, aby się poruszać. Możesz również zobaczyć, że jeśli którakolwiek skała ma dużo energii kinetycznej, w rzeczywistości przejdzie przez głębszą dolinę i skończy gdzieś za prawą stroną obrazu.
Co możemy od tego wyciągnąć, że potencjalne powierzchnie energii mówią nam, gdzie rzeczy chcą (używam tego terminu bardzo luźno), podczas gdy energia kinetyczna mówi nam, czy są w stanie aby się tam dostać.
Spójrzmy na inny obraz mikroskopowy:
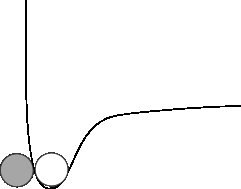
Atomy z wcześniejszych czasów mają najniższą energię potencjalną. Aby się rozpadły, musisz dać im trochę energii kinetycznej.
Jak dajemy energię kinetyczną atomów? Zwiększając temperaturę . Temperatura jest bezpośrednio związana z energią kinetyczną - wraz ze wzrostem temperatury rośnie także średnia energia kinetyczna każdego atomu i cząsteczki w układzie.
Do tej pory możesz być w stanie zgadnij, jak podwyższenie temperatury wody pomaga jej skuteczniej czyścić, ale spójrzmy na kilka szczegółów, aby mieć pewność.
Rozpuszczalność
Możemy zrobić mikroskopowy obraz energii potencjalnej i kinetycznej i wyciągnij z niego dwie ważne wskazówki:
- Wszystkie atomy są „lepkie”, chociaż niektóre są bardziej lepkie niż inne
- Wyższe temperatury oznaczają, że atomy mają większe energie kinetyczne
Wracając do pytania o filiżankę kawy, wszystko, co musimy teraz zrobić, to zastanowić się, jak będą one współgrać z konkretnymi cząsteczkami, na które patrzysz.
Kawa to mieszanka wielu różnych rzeczy - olejów, związków rozpuszczalnych w wodzie, spalonych węglowodorów (jak na starą filiżankę kawy) itp. Każda z tych rzeczy ma inną „lepkość”. Oleje wcale nie są zbyt lepkie - siły przyciągania między nimi są dość słabe. Związki rozpuszczalne w wodzie są bardzo „lepkie” - silnie się przyciągają, ponieważ mają duże ładunki. Ponieważ cząsteczki wody mają również duże ładunki, to właśnie sprawia, że związki rozpuszczalne w wodzie są rozpuszczalne w wodzie - łatwo przylegają do wody. Spalone węglowodory nie są zbyt lepkie, podobnie jak oleje.
Ponieważ cząsteczki o dużych ładunkach mają tendencję do przyklejania się do cząsteczek wody, nazywamy je hydrofilowymi - co oznacza, że „kochają” wodę . Cząsteczki, które nie mają dużych ładunków, nazywane są hydrofobowymi - „boją się” wody. Chociaż nazwa sugeruje, że są odpychane przez wodę, ważne jest, aby wiedzieć, że w rzeczywistości nie ma żadnych sił odpychających między wodą a związkami hydrofobowymi - po prostu woda tak bardzo się lubi, związki hydrofobowe są wykluczone i kończą się przyklejaniem do siebie .
Wracając do brudnej filiżanki kawy, kiedy dodajemy wodę i zaczynamy szorować, dzieje się wiele rzeczy:
Związki hydrofilowe
Związki hydrofilowe szybko rozpuszczają się w wodzie, ponieważ bardzo dobrze przylegają do wody w porównaniu do tego, jak dobrze przylegają do siebie i do kubka. W przypadku, gdy przylegają do siebie lub do kubka lepiej niż do wody, różnica nie jest duża, więc wprowadzenie ich do wody nie wymaga dużej energii kinetycznej. Tak więc ciepła woda ułatwia ich rozpuszczanie.
Związki hydrofobowe
Związki hydrofobowe (oleje, przypalenia, większość plam) nie przyczepiają się do wody. Przyklejają się trochę do siebie (pamiętaj, że siły są znacznie słabsze w porównaniu z wodą, ponieważ ładunki są bardzo małe), ale woda przylega do siebie tak dobrze, że oleje nie mają szansy dostać się między cząsteczki wody. Możemy je szorować, co dostarczy wystarczającej ilości energii, aby je uwolnić i pozwolić wodzie je unieść, ale gdybyśmy również zwiększyli energię kinetyczną poprzez podwyższenie temperatury wody, moglibyśmy pokonać obie słabsze siły utrzymujące hydrofobowy związki razem, jednocześnie nadając cząsteczkom wody większą ruchliwość, dzięki czemu mogą się rozsuwać i wpuszczać związki hydrofobowe. Dlatego też cieplejsza woda ułatwia również wypłukiwanie związków hydrofobowych.
Makroskopowe Widok
Możemy to powiązać z pierwotną dyskusją na temat termodynamiki i kinetyki. Jeśli podniesiesz temperaturę wody, odpowiedź na pytanie „Ile się rozpuści” brzmi „więcej”. (To była część dotycząca termodynamiki). Odpowiedź na pytanie „Jak długo to potrwa” brzmi „nie tak długo” (kinetyka).
I jak powiedział @anna, są inne rzeczy, które możesz zrobić, aby było to jeszcze łatwiejsze. Na przykład mydło składa się z cząsteczek o długim łańcuchu z jednym końcem naładowanym i jednym nienaładowanym. Oznacza to, że jeden koniec jest hydrofilowy, a drugi koniec hydrofobowy. Kiedy dodasz mydło do obrazu, hydrofilowy koniec trafia do wody, podczas gdy hydrofobowy koniec próbuje otoczyć oleje i spalone rzeczy. Ostatecznym wynikiem są małe „bąbelki” (zwane micelami ) zbudowane z cząsteczek mydła otaczających cząsteczki hydrofobowe, które z kolei są otoczone wodą.